La malaria es una enfermedad potencialmente mortal causada por parásitos del género Plasmodium, que se transmiten al ser humano por la picadura de mosquitos anófeles infectados. De acuerdo con la Organización Mundial de la Salud, las especies más peligrosas son Plasmodium falciparum y Plasmodium vivax.
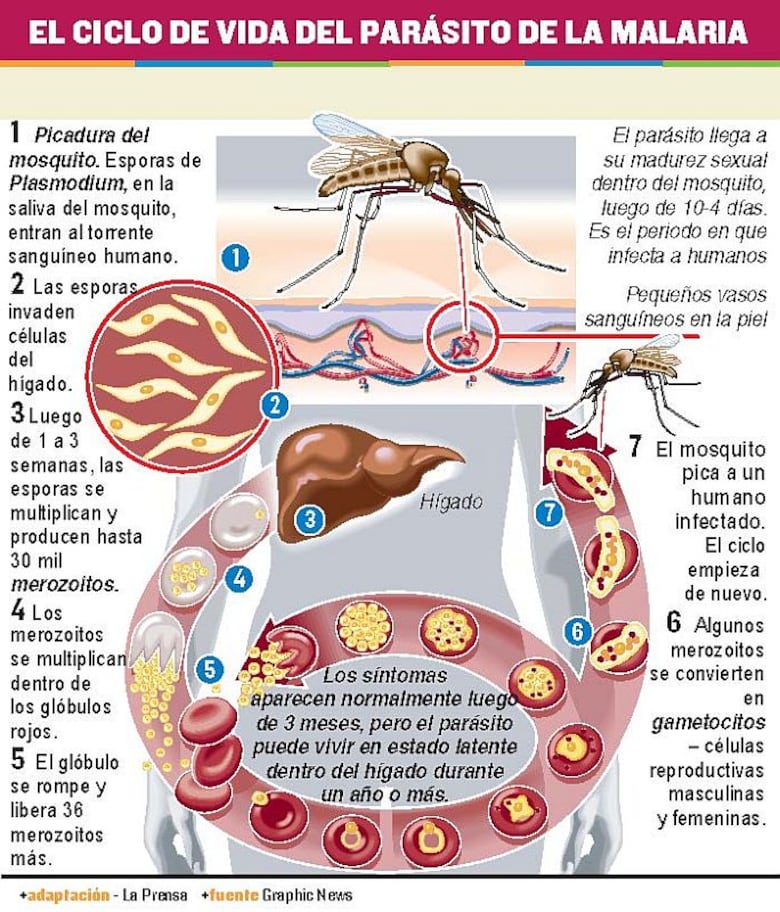
Los científicos buscan cómo tratar esta enfermedad con métodos preventivos –como las vacunas– o terapéuticos –con drogas y dispositivos capaces de matar a los parásitos. Pero es una labor compleja, debido a que el ciclo de vida del parásito transcurre dentro de los mosquitos y también en el cuerpo de la persona infectada (ver infografía).
Un nuevo estudio, liderado por el investigador panameño Nicanor Obaldía III —afiliado al Instituto Conmemorativo Gorgas de Estudios de la Salud (Icges) y al Departamento de Inmunología y Enfermedades Infecciosas de la Universidad de Harvard— señala que el lento progreso en vacunas contra la malaria refleja los retos que enfrentan los desarrolladores, que incluyen, identificar antígenos adecuados, seleccionar las vías de administración óptimas para las vacunas, y formularlas con adyuvantes que favorezcan una respuesta inmune consistente.
“Un enfoque para mejorar la protección es combinando múltiples antígenos. Otra forma es usando estrategias de inmunización heteróloga de prime-boost”, detalla el estudio.
La estrategia prime-boost se refiere a un esquema de inmunización en el cual se administra primero una vacuna de ADN y después una de proteínas o virus recombinantes, para provocar una respuesta secundaria.
Esta investigación —en la que participan también científicos del Centro Naval de Investigación Médica de Silver Spring (Estados Unidos) y de la compañía Vaxin Inc.— aborda la eficacia de dos antígenos contra P. vivax administrados a primates del género Aotus mediante dos vías: un plásmido de ADN y un vector adenoviral.
En febrero de este año, este trabajo fue aceptado para su publicación por la revista Clinical Vaccine Immunology de la Sociedad Americana de Microbiología.
PLÁSMIDOS DE ADN
“El cultivo in vitro permite encontrar proteínas inmunogénicas y hacer experimentos con nuevas técnicas para enviar vacunas a los recipientes, incluyendo los plásmidos de ADN”, explica el Dr. Obaldía.
Un plásmido es un fragmento circular de ADN obtenido de una bacteria, que le confiere protección contra otras bacterias y la resistencia a los antibióticos.
A diferencia de P. falciparum, P. vivax no se puede cultivar in vitro, añade Obaldía. No obstante, los científicos pueden “cosechar” los plásmidos de bacterias como la Escherichia coli y les añaden genes que codifican proteínas específicas que brindan protección contra un agente patógeno.
Durante años se han desarrollado y patentado plásmidos para diferentes enfermedades. Y se ha encontrado que la vía intradérmica es mejor que la intramuscular para inocular un plásmido.
Cuando un agente extraño penetra la piel, los histiocitos –unas células con forma estelada– actúan como macrófagos y lo engullen. Al inocular un plásmido en la piel, los histiocitos no pueden destruirlo y la proteína deseada comienza a reproducirse en las células dendríticas.
UN RÉGIMEN ESPECIAL DE APLICACIÓN
Cuando se administra una vacuna, el cuerpo tiene dos tipos de respuestas: la humoral, que es mediada por los anticuerpos; y la inmunidad celular, en la cual se atacan directamente las células que contienen el parásito o el virus y se produce su ruptura o destrucción.
Durante su ciclo de vida, el parásito de la malaria produce unas células llamadas merozoitos.
Cuando una persona es picada por un mosquito infectado, los merozoitos invaden los glóbulos rojos, los revientan y salen por el sistema circulatorio (ver infografía). Es a esta fase que apunta la investigación del Dr. Obaldía y su equipo.
El antígeno 1 apical de membrana (AMA1) y la proteína 1 de superficie de merozoitos (MSP142), que intervienen en la fase sanguínea del ciclo del P. vivax, han demostrado de forma individual que pueden inducir parcialmente una respuesta inmunológica protectora en los primates Aotus.
El Dr. Obaldía y sus colegas probaron ambos antígenos. Primero administraron el plásmido en un esquema de inmunización en intervalos de cuatro semanas.
Se hacían tres inmunizaciones intradérmicas y se extraían muestras de sangre para medir los anticuerpos.
Después de 12 semanas se aplicaba otro vector: un adenovirus del resfriado común que fue inutilizado para que no pudiera replicarse como tal, pero que bloquea las interacciones entre proteínas y receptores celulares que le permiten al parásito en fase de merozoito “pegarse” a los glóbulos rojos y penetrarlos.
Bajo este esquema, los anticuerpos comienzan a subir, se normalizan, y cuando se introduce el adenovirus modificado con la proteína, el sistema inmune la reconoce y se produce un efecto potenciador o de boosting; o sea, se elevan los anticuerpos.
Los primates se dividieron en grupos de cuatro o cinco ejemplares. Unos fueron inmunizados con el plásmido y con el vector de adenovirus vacíos, como control.
Otro grupo recibió el plásmido con AMA1 y el adenovirus con AMA1. El tercer grupo recibió el plásmido y el adenovirus con MSP142.
El grupo D recibió una combinación de AMA1 y MSP142, tanto en el plásmido, como en el vector de adenovirus.
Al grupo E se le dio el ADN con AMA1 y MSP142 y el adenovirus de control.
El grupo F fue inmunizado con el ADN de control y el adenovirus con ambos antígenos. Y el grupo G no fue inmunizado, sino que sirvió de control para comprobar que la infección estaba presente.
Es decir, que los animales recibieron distintas combinaciones de ambos antígenos, y unos sirvieron de control.
“Hay una controversia sobre si la AMA1 es mejor que la AMSP142. En este experimento lo que vimos es que la combinación de los dos cotroló la infección en los animales y se curaron solos. No se les dio droga”, menciona el Dr. Obaldía.
El documento señala que la hipótesis era que un enfoque heterólogo de prime-boost, basado en genes y usando dos antígenos, induciría una respuesta inmune más fuerte y amplia y una inmunidad humoral, mejorando la protección, tal como fue demostrado por la parasitemia reducida en primates Aotus que fueron expuestos a la fase sanguínea con parásitos de P. vivax.
La MSP1 se relacionó más con una menor carga parasitaria, pero una gran proporción de los animales inmunizados desarrolló anemia.
El estudio concluye que el régimen de inmunización heterólogo con el par de antígenos fue más protector que los antígenos solos o que ambos antígenos entregados en una sola plataforma de vacuna, demostrando la viabilidad de usar estos antígenos y régimen de inmunización en futuros desarrollos.
Puede acceder a la publicación online ahead of print en este enlace: https://www. ncbi.nlm.nih.gov/pubmed/ 28179404.
PERFIL
TRAYECTORIA. Nicanor Obaldía Rodríguez es médico veterinario graduado en la Universidad Nacional de Colombia- Bogotá. Tiene un Master of Science de la Universidad de Wisconsin-Madison y un doctorado de Ciencias, con énfasis en Inmunología y Enfermedades Infecciosas, Epidemiología y Bioestadís- tica en Salud Pública, de Harvard University.
Ha trabajado por más de 25 años con el Instituto Walter Reed. Es profesor asociado del Depto. de Salud Global de la Universidad de South Florida USF-Tampa. Ha estudiado también los estadios de transmisión de ‘P. vivax’ al mosquito ‘Anopheles albimanus’ con la Universidad de Glasgow.





