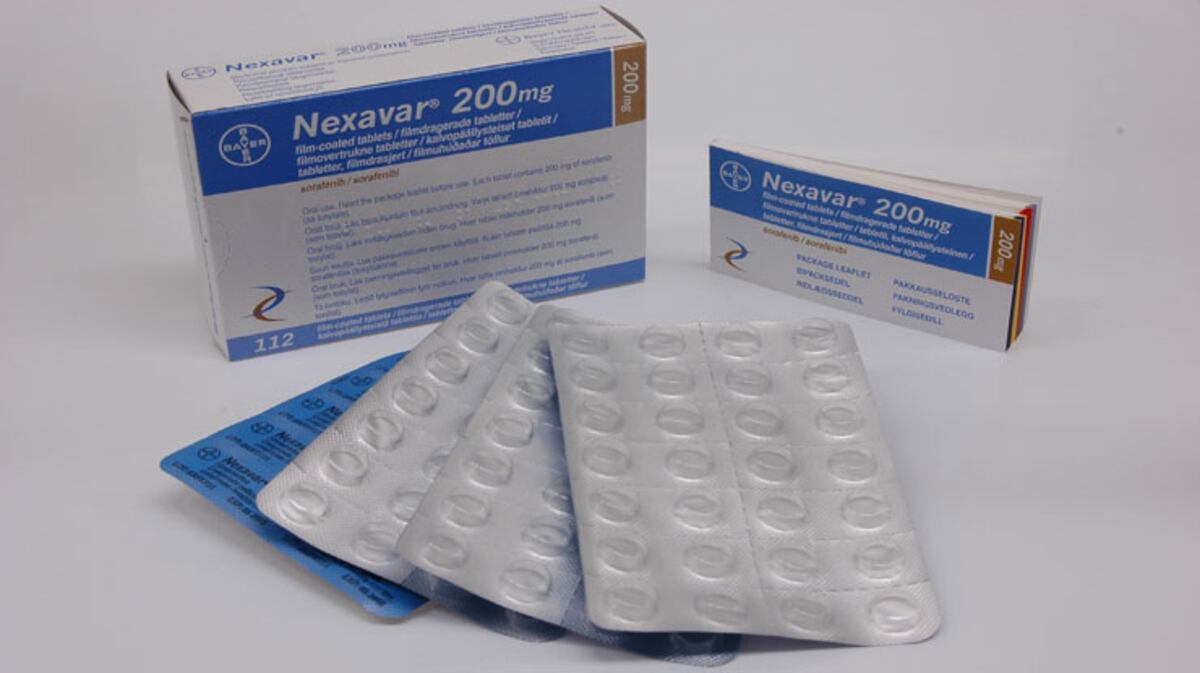
Mediante una nota de “seguridad de medicamentos” fechada el 5 de agosto, la Dirección Nacional de Farmacia y Drogas del Ministerio de Salud (Minsa) alertó sobre el riesgo potencial de padecer el síndrome de lisis tumoral (TLS, por sus siglas en inglés) con el uso de Nexavar (Sorafenib).
La nota explica que Nexavar es un medicamento utilizado para el tratamiento del cáncer de hígado que no puede ser tratado con cirugía, así como para el cáncer de riñón en etapa avanzada.
El TLS es una afección potencialmente mortal que puede ocurrir durante el tratamiento del cáncer. Se presenta cuando las células cancerosas mueren y liberan su contenido (sales y proteínas) en la sangre. Si estas células se descomponen más rápido de lo que los riñones pueden eliminar dichas sustancias, se pueden producir cambios en el equilibrio químico del cuerpo, lo que puede causar daños en los riñones, el corazón y el cerebro.
El Departamento de Salud de Canadá (Health Canada) identificó nueve casos internacionales de TLS posiblemente relacionados con pacientes que tomaban el medicamento. De estos, cinco pacientes fallecieron, y se determinó que muy posiblemente sus muertes estaban relacionadas con el TLS a causa del tratamiento con sorafenib, el principio activo de Nexavar.
En Panamá, está registrado un producto comercial que contiene sorafenib: los comprimidos de Nexavar de 200 miligramos de la farmacéutica Bayer AG, con registro sanitario 1927.
Hasta la fecha, el Centro Nacional de Farmacovigilancia ha recibido 90 reportes de sospecha de reacciones adversas asociadas al sorafenib, tales como: edema pulmonar, dolor articular y dental, mareos, fatiga, infección pulmonar, dificultad para tragar, erupciones cutáneas e irritación en la piel.
Anteriormente, el Minsa ya había alertado que este medicamento estaba relacionado con la microangiopatía trombótica (MAT), un grupo de afecciones que implica la formación de coágulos en vasos sanguíneos pequeños.